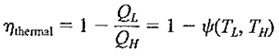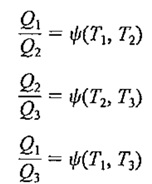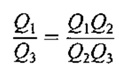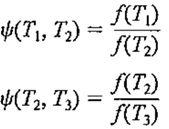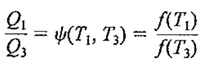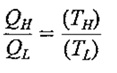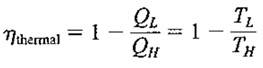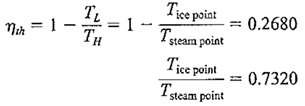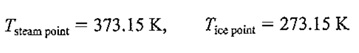تعریف دما[۱]
دما ابزاری مقایسه ای، برای تعیین میزان سردی وگرمی اجسام می باشد ومقدار آن توسط ترمومتر اندازه گیری می شود. کمیت دما دارای واحدهای مختلفی نظیر سلسیوس ، کلوین وفارنهایت است .
مقیاس فارنهایت بر این اساس تنظیم شده که عدد ۳۲ را برای دما نقطه یخ زدن آب و ۲۱۲ را برای دما نقطه ی جوش آب انتخاب کرده و فاصله ی بین آنها را به ۱۸۰ واحد تقسیم نموده است. واحد فارنهایت برای سنجش دما براساس کار فیزیکدان آلمانی قرن هجدهم میلادی، گابریل فارنهایت تنظیم شده است. در واقع او عدد صفر مقیاسش را برای مخلوط یخ ونمک و عدد ۳۰و ۹۰ را به ترتیب برای نقطه ی یخ زدن آب و دمای نرمال بدن انتخاب کرد که بعدها این اعداد به ۳۲ و ۹۸٫۶ تغییر پیدا کردند . تا سال ۱۹۷۰ میلادی در بسیاری از کشورهای انگلیسی زبان، از فارنهایت به عنوان واحد اصلی دما استفاده می شد اما به مرور زمان به واحد سلسیوس تغییر پیدا کرد.
- کلوین[۴]
این واحد دما به افتخار ویلیام بارون کلوین فیزیکدان انگلیسی نام گذاری شده است و به عنوان واحد دمایی پایه برای اندازه گیری های ترمودینامیکی، از طرف موسسه بین المللی استاندارد اندازه گیری[۵](SI) تعیین شده است. در واقع این واحد به صورت ۲۷۳٫۱۶ / ۱ نقطه سه گانه ی[۶] آب خالص (نقطه ای که سه فاز جامد، مایع و گاز یکسان هستند) تعریف شده است. صفر این واحد را بعنوان صفر مطلق[۷] نام گذاری کرده اند که طبق تعریف معادل نقطه ای است که انرژی مولکولی ماده در پایین تریین سطح خود قرار می گیرد . طبق تعریف به دلیل آنکه واحد کلوین برای دما به صورت یک واحد مطلق شناخته می شود و همچنین نوشتن بسیاری ازفرمول ها در یک واحد با مقیاس مطلق بسیار ساده تر است، بر این اساس این واحد به عنوان واحد اندازه گیری دما ی مرجع در محاسبات علمی مورد استفاده قرار گرفته است.
- سلسیوس[۸]
این واحد در سال ۱۷۴۲ توسط ستاره شناس سوئدی، آندرس سلسیوس ساخته شد. این واحد را با نام سانتی گراد نیز می شناسند و دارای صد قسمت است که دما نقطه یخ زدن آب را صفر و نقطه جوش آب را ۱۰۰ گذاشته اند . این واحد به عنوان واحد مرجع در سیستم متریک به کار برده می شود. برای تبدیل دما در واحد سلسیوس به فارنهایت می توان از رابطه ی (۱) استفاده کرد :
F = 9/5C + 32
همچنین برای تبدیل سلسیوس به کلوین می توان از رابطه ی (۲) استفاده کرد :
k=273.16+C
طبق این رابطه صفر درجه ی سلسیوس معادل ۲۷۳٫۱۶ درجه کلوین می باشد .
 درجه بندی سلسیوس در برابر کلوین- برگرفته از سایت "http://abyss.uoregon.edu/"
درجه بندی سلسیوس در برابر کلوین- برگرفته از سایت "http://abyss.uoregon.edu/"
-
نگاهی به دما ازدیدگاه ترمودینامیکی
-
انواع مقیاس های دمایی
-
به طور کلی می توان مقیاس های دمایی را بردو مبنای تجربی[۹] و تئوری[۱۰] طبقه بندی نمود. مقیاس تجربی، دارای سابقه ای طولانی تر از مقیاس های تئوری می باشد . در ادامه به توضیح این دو مقیاس می پردازیم.
-
مقیاس های برمبنای تجربی
مقیاس های تجربی دما، اساسا بر مبنای اندازه گیری ویژگی های ساده ی مواد استوار است. به عنوان مثال، اساس کار دماسنج جیوه ای برمبنای جابه جایی جیوه در داخل لوله ی شیشه اش می باشد که آن هم به نوبه خود، ارتباط بادمای جیوه دارد .چنین مقیاس هایی تنها در بازه ی محدودی از دما معتبر می باشند مثلا اگر دمای جیوه به دمای جوشش برسد، دیگر نمی توان از این مقیاس استفاده کرد. ولی با وجود این گونه معایب، اکثر دماسنج ها براساس همین نوع مقیاس بندی ساخته می شوند. درکل می توان از مقیاس بندی های تئورری، برای کالیبره کردن مقیاس بندی تجربی بهره برد.
-
مقیاس های برمبنای تئوری
مقیاس بندی تئوری بر مبنای اصول ترمودینامیک، مکانیک کوانتوم و تئوری جنبشی گازها بنیان شده است. اصول این مقیاس بندی بر اساس خواص مواد و دستگاهها در حالت ایده آل می باشد. از این نوع مقیاس بندی، برای کالیبره کردن دستگاههای با مقیاس بندی تجربی استفاده می شود. به عنوان نمونه، مقیاس کلوین، یک مقیاس تئوری است که برمبنای سیکل ایده آل کارنو[۱۱] طراحی شده است. در ادامه، برای درک بهتر مقیاس بندی های بر مبنای تئوری ، به مقیاس بندی کلوین که بر مبنای کار تئوری صورت گرفته می پردازیم.
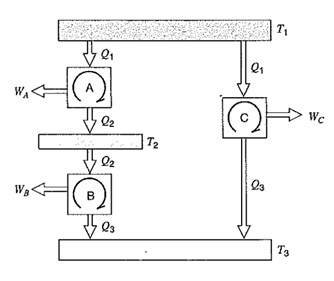
بهتر است که یک مقیاس درجه حرارت مستقل از هر نوع ماده ای باشد. سیکل کارنو مستقل از هر نوع ماده ی کاری می باشد و تنها تابع درجه حرارت است. مفهوم این مقیاس درجه حرارت را، به کمک شکل زیر، که درآن سه موتور حرارتی و سه منبع حرارتی در سیکل کارنو کار می کنند، توضیح داد . T1 بزرگترین منبع درجه حرارت، T3 کوچکترین منبع درجه حرارت و T2 منبع درجه حرارت متوسط هستند و موتورها بین دو منبع مختلف نشان داده شده کار می کنند. Q1 در هر دو موتور A و C یکسان است وچون در مورد سیکل های باز گشت پذیر صحبت می کنیم Q3 برای موتور های B و C یکسان خواهد بود .(Q ها نماینده ی کار مبادله شده با هر منبع و W ها نشانگر کار انجام شده توسط هر موتور)
چون کارایی سیکل کارنو فقط تابع درجه حرارت است وتنها به درجه حرارتی که بین دو منبع کار می کند بستگی دارد می توان بازده حرارتی سیکل کارنو را به صورت زیر نوشت :
که درآن ψ نمایانگر رابطه ی تابع است .
حال این رابطه را در مورد هر یک از سه سیکل بالا(سه موتور وسه منبع حرارتی ) به کار می بریم :
چون
پس نتیجه می شود
باید خاطر نشان کرد که چون طرف چپ معادله ی آخرِ تنها تابع T1 و T3 است پس طرف راست آن نیز باید تنها تابع T1 وT3 باشد. از این مطلب می توان نتیجه گرفت که شکل تابع ψ باید به صورت زیر باشد:
بنابراین می توان f(T2) را از حاصلضرب (T1,T3)ψ حذف کرد ونتیجه گرفت که :
و در شکل کلی تر می توان نوشت :
اکنون، چند رابطه مختلف برای تابع f می توان در نظر گرفت. رابطه ی برگزیده ای که اولین بار لرد کلوین در نظر گرفت به صورت زیر بود :
با تعریفی که از درجه حرارت مطلق داشتیم، می توان بازده ی سیکل کانو را به صورت زیر نوشت :
این بدان معنی است که اگر کارایی سیکل کارنویی که بین دو منبع درجه حرارت ثابت کار می کنند مشخص باشد نسبت دو درجه حرارت مطلق نیز مشخص خواهد بود.
در ادامه فرض کنید که یک موتور حرارتی داریم که در یک سیکل کارنو کار می کند و حرارت را در دجه حرارت نقطه ی تبخیر دریافت می کند و در درجه حرارت انجماد آن رادفع می کند. (چون سیکل کارنو شامل فرآیندهای بازگشت پذیر است ساخت چنین موتور حرارتی و انجام آزمایش پیشنهادی غیر ممکن است ولی می توان آزمایش را به طور ذهنی انجام داد تا از این طریق مقیاس درجه حرارت ترمودینامیکی را بهتر درک کرد) اگر کارایی چنین موتوری را بتوان اندازه گرفت، مقدار آن ۲۶٫۸ خواهد بود. بنابراین با استفاده از فرمول بازده سیکل حرارتی کارنو داریم :
رابطه ی فوق معادله ی با دو مجهول TL وTH را به دست می دهد. معادله ی دومی که به کار می بریم، با تصمیم اختیاری در مورد اندازه ی درجه حرارت در مقیاس درجه حرارت ترمودینامیکی حاصل می شود. اگر بخواهیم اندازه درجه روی مقیاس مطلق، متناظر با اندازه ی درجه حرارت روی مقیاس سلسیوس باشد ، می توان نوشت :
با حل همزمان معادلات فوق داریم :
در نتیجه خواهیم داشت :
این همان مقیاسی است که در تبدیل درجه حرارت سلسیوس به کلوین استفاده می کنیم .
-
نگاهی به دما بادیدگاه تئوری جنبشی
در تئوری جنبشی، دما به صورت متوسط انرژی جنبشی ذرات تشکیل دهنده ی ماده در نظر گرفته می شود. در این تئوری، هر ماده ای از ذرات ریز یکسانی تشکیل شده که آزادانه در حال حرکت در داخل ماده می باشند. هر کدام از این ذرات(ذرات کروی)، دارای آزادی حرکت در سه جهت مستقل (x,y,z) می باشند. شایان ذکر است در مولکول ها یا ذراتی که دارای شکل کروی نمی باشند( مانند اکسیژن ) ذرات دارای درجه ی آزادی حول سه محور x,y,z وهمچنین قابلیت حرکات ارتعاشی نیز می باشند. در کل، ذرات کروی شکل دارای انرژی جنبشی خطی kBT/2 به ازای حرکت آزادانه در هر جهت مختصاتی می باشند(kBضریب بولتزمن و T دمای جسم است ).متوسط این این انرژی در سه جهت مختصاتی kBT/23 می باشد. گرما دادن به یک سیستم، سبب افزایش دمای آن سیستم خواهد شد زیرا متوسط انرژی جنبشی خطی ذرات افزایش می یابد . این انرژی برای مواد تک اتمی(مانند گاز های نجیب) می باشد که البته برای موادی با ذرات چند اتمی این انرژی با انرژی هایی نظیر انرژی دورانی و ارتعاشی ذرات جمع می شود و به این علت است که برای بالا بردن دمای این گونه مواد باید گرمای بیشتری مصرف کرد.
-
ظرفیت گرمایی[۱۲]
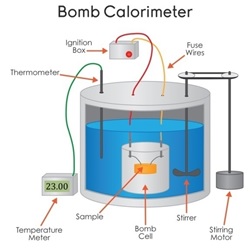
ظرفیت گرمایی یک سیستم عبارت است از مقدار گرمایی که باید به آن سیستم داد تا دمای آن یک درجه (سلسیوس یا کلوین) بالا رود. واحد به کاررفته برای این عبارت ، گرما بر دما می باشد . برای اندازه گیری ظرفیت واکنش ها می باید از کالری متر استفاده کرد. از بمب کالری متر[۱۳]، برای محاسبه ی ظرفیت گرمایی واکنش های در حجم ثابت استفاده می شود .
بمب کالری متر وسیله ای است که از آن برای محاسبه ی گرمای واکنش های شیمیایی، در حجم ثابت استفاده می کنند. سوخت در داخل محفظه ای با حجم معین قرار می گیرد و متعاقبا به وسیله ی جرقه زن الکتریکی، مشتعل می شود. فرآیند احتراق، گرمای واکنش را به آب اطراف محفظه ی احتراق می دهد و در نتیجه دمای آب بالا می رود . به کمک تغییرات دمای آب، می توان گرمای واکش را تقریب زد. در شکل زیر، مکانیزم عملکردی بمب کالریمتر قرار داده شده است.
-
تئوری های شکل دهنده ی ترمودینامیک
- تئوری انرژی جنبشی گازها
(برای مطالعه بیشتر به قانون گازها ومدل آنها مراجعه گردد )
-
قانون صفرم ترمودینامیک[۱۴]
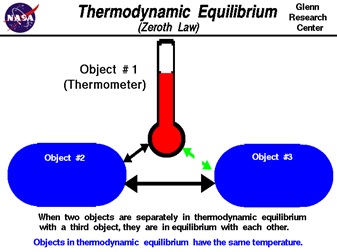
بیان قانون صفرم ترمودینامیک، با تعریف اصطلاح تعادل ترمودینامیکی آغاز می شود. دیده می شود که خصوصیات مواد از قبیل فشار یک گاز، طول یک میله ی فلزی ویا رسانایی یک سیم به علت حرارت دادن به آنها و یا حرارت گرفتن از آنها تغییر می کند. اگر دو جسمی را که به آنها حرارت داده ایم به هم وصل کنیم در ابتدا شاهد تغییر در خواص آنها می باشیم اما در نهایت میبینیم که تغییرات خواص آنها متوقف می شود. به این حالت در اصطلاح تعادل گرمایی یا تعادل ترمودینامیکی[۱۵] گفته می شود .
زمانی که دو جسم با هم در تعادل ترمودینامیکی هستند گفته می شود که دارای دمای یکسانی می باشند. برای رسیدن به تعادل ترمودینامیکی، گرما بین دو جسم مبادله می شود. چگونگی رسیدن به تعادل، در قوانین اول و دوم ترمودینامیک بررسی می شود.
قانون صفرم ترمودینامیک، در واقع یک قانون بر مبنای مشاهده می باشد. فرض کنید سه جسم ۱ و ۲ و ۳ داریم. همچنین فرض کنید که جسم ۲ با جسم ۱ وهمچنین جسم ۳ با جسم ۱در تعادل ترمودینامیکی هستند. طبق قانون صفرم ، دو جسم ۲ و ۳ نیز باهم در تعادل ترمودینامیکی هستند و دمای سه جسم یکسان می باشد .
-
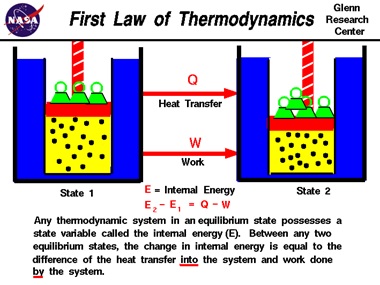
قانون اول ترمودینامیک [۱۶]
در آزمایشات ترمودینامیکی مشخص شده است که کاری که توسط سیستم و یا بر روی سیستم انجام می شود علاوه بر این که به حالت اولیه و نهایی سیستم بستگی دارد به نوع فرآیند یا همان مسیر ترمودینامیکی که ماده ی کاری سیستم طی نموده بستگی دارد. در مورد گرمای داده شده و یا گرفته شده به سیستم نیز وضعیت به همین ترتیب است. در بررسی هایی که بر روی گاز کامل به عمل آمده، مشاهده شده است که کار خالص و یا گرمایی که به گاز گرفته و یا داده می شود تنها تابع حالت ابتدایی و انتهایی گاز می باشد و پروسه ای که گاز دستخوش آن شده بستگی ندارد. این وضعیت منجر به طرح متغیر جدیدی به نام انرژی درونی[۱۷] شده که تابع حالت ابتدایی و انتهایی فرآیند است و به مسیر پروسه بستگی ندارد. در واقع انرژی درونی ، یک متغیر حالت همانند فشار و دماست. قانون اول ترمودینامیک، انرژی درونی را به صورت اختلاف گرمای داده شده به سیستم، با کار گرفته شده از سیستم تعریف می کند :
E2-E1=Q-W
گفتنی است طبق قرارداد، گرمایی که از سیستم خارج می شود منفی و کاری که روی سیستم انجام می شود را مثبت در نظر می گیریم.
انرژی درونی ، همانند انواع انرژی نظیر جنبشی و پتانسیل، نوعی انرژی است که قابلیت تبدیل شدن به انواع انرژی را داراست . در مورد گاز کامل ( گاز ایده آل )، طبق محاسبات به عمل آمده انرژی درونی گاز کامل تنها تابع دمای گاز می باشد .
-
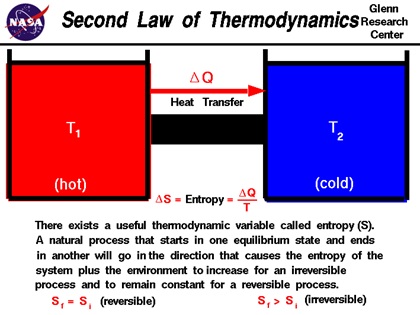
قانون دوم ترمودینامیک[۱۸]
می توان فرآیند های ترمودینامیکی را تصور کرد که با قانون اول ترمودینامیک همخوانی داشته باشند اما هیچگاه در طبیعت رخ ندهند. به عنوان مثال، فرض کنید دو میله ی سرد و گرم با هم در تماس باشند و حرارت از میله ی بادمای پایین تر به میله ی با دمای بالاتر انتقال یابد که در نتیجه ی آن میله ی سرد، سرد تر و میله ی گرم ، گرم تر شود . این فرآیند با قانون اول ترمودینامیک همخوانی دارد اما هیچگاه در طبیعت اتفاق نمی افتد . ترمودینامیک، امکان واقع شدن پدیده های فیزیکی وشیمیایی را در جهان واقعیت، به وسیله ی قانون دوم ترمودینامیک توضیح می دهد .
برای توضیح قانون دوم ترمودینامیک، فرض کنید متغیر حالت دیگری به نام انتروپی[۱۹] را تعریف کنیم . این متغیر حالت، متغیری همانند دما می باشد . تغییر این متغیر به صورت زیرنشان داده می شود:
که در این معادله ds مقدار تغییر انتروپی، Q مقدار حرارت مبادله شده با یک سیستم و T دما می باشد . در یک فرآیند انجام شده در صورتی که آن فرآیند برگشت پذیر[۲۰] باشد، تغییر انتروپی مجموع سیستم و محیط اطرافش صفر می باشد . به فرآیندی که تغییر انتروپی آن صفر باشد، فرآیند ایزنتروپیک[۲۱] می گویند. در صورتی که فرآیندی برگشت ناپذیر باشد ، تغییر انتروپی محیط و سیستم ، مقداری مثبت می باشد که اصطلاحا به آن تولید انتروپی می گویند. طبق قانون دوم ترمودینامیک، فرآیند و یا واکنشی در واقعیت امکان پذیر است که در آن تولید انتروپی وجود داشته باشد.
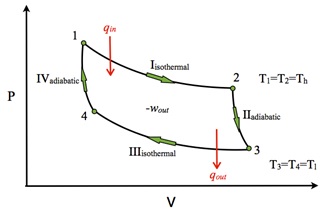
در قسمت توضیحات برای مقیاس های تئوری، گفته شد که مقیاس کلوین بر اساس سیکل فرضی کارنو بنا نهاده شده است. سیکل کارنو در واقع، سیکل ایده آلی است که بسیاری از فرآیندهای ترمودینامیکی را با آن تقریب می زنند. این سیکل، شامل دو فرآیند ایزنتروپیک برگشت پذیر و دو فرآیند هم دمای برگشت پذیر می باشد . اگر وسیله ای بر طبق این سیکل عمل کند دارای ماکزیمم راندمان می باشد به همین دلیل از این سیکل به عنوان یک سیکل مرجع در فرآیند های ترمودینامیکی استفاده می کنند .
قانون سوم ترمودینامیک[۲۲]
طبق این قانون، انتروپی مواد در دما ی صفر مطلق(صفر کلوین )، صفر می باشد . در این دما انرژی در کمترین حالت ممکن می باشد و تمامی حرکات ذرات اعم از لغزشی ، دورانی وارتعاشی صفر می باشد. در این تعریف ، چون انتروپی مواد در دمای صفر کلوین ، صفر تعیین می شود می توان با استفاده از این نقطه ی مرجع به محاسبه ی انتروپی مواد دست زد .
- Temprature
- Temprature scales
- Fahrenheit
- Kelvin
- International system of measurement
- Triple point
- absolute zero
- Celsius
- emperical
- theoretical
- carnot
- heat capacity
- calorimeter bomb
- zeroth law of thermodynamics
- thermodynamics equibliruim
- firstlaw of thermodynamics
- internal energy
- second law of thermodynamics
- entropy
- reversible
- isentropic
- third law of thermodynamics