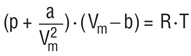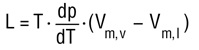
- تئوری پیوستگی[۱]:
تئوری پیوستگی وخلاصه ای از قاون گاز ها و مدل های گازی که در ادامه می آیند همگی براساس تجربه به دست آمده اند و در فرایندهایی که در نزدیک فشاراتمسفر هستند، معتبر می باشند. تنها زمانی که فرآیند خلا سازی به حدی برسد که متوسط مسیر آزادذرات، از ابعاد محفظه خلا بسیارفراتربروند، می توان گفت که نیاز به فرضیه های جدیدی می باشد ودر اینجا تئوری انرژی جنبشی گازها دیگر معتبرنیست. تئوری انرژی جنبشی گازها در بازه وسیعی از فشارها به کارمی رود اما تئوری پیوستگی تنها در فشارنزدیک به فشاراتمسفرکاربرد دارد.
خلاصه ای از مهمترین قوانین گاز در حیطه ی تئوری پیوستگی
-
قانون گاز بویل - ماریوت[۲]
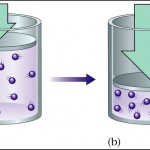
این قانون که یک قانون تجربی است، اولین بار توسط بویل، شیمیدان وفیزیکدان انگلیسی در ۱۶۶۲کشف شد. البته این قانون به طور مستقل توسط ماریوت نیز، در سال ۱۶۷۹نیز کشف شدکه چون زودتر توسط بویل به چاپ رسیده بود، به قانون بویل معروف شد اما در بسیاری ازموارد آن را به قانون بویل - ماریوت نیز می شناسند. این قانون می گوید در صورت داشتن یک محفظه ی پراز گازساکن،با شرط ثابت نگه داشتن جرم ودمای گاز، تغییر فشار نسبت عکس با حجم گاز خواهد داشت. در زیر رابطه ی فشاروحجم نشان داده شده است:
PV = constant
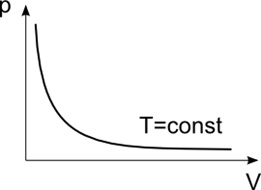 قانون بویل - ماریوت-برگرفته ازسایت " http://unicalc.net"
قانون بویل - ماریوت-برگرفته ازسایت " http://unicalc.net"-
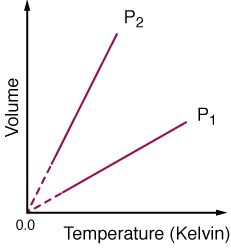
قانون گاز گی - لوساک [۳](قانون شارل)
توصیف رابطه بین دما وحجم گاز، برای یک گاز با جرم وفشارثابت را قانون گی - لوسک یا قانون شارل می گویند. این قانون در ابتدا توسط شارل کشف شد و بعدا توسط گی-لوساک تایید گردید این قانون بیان می کنداگر گازی را با شرط فشار وجرم ثابت داشته باشیم حجم ودمای گاز رابطه ی مستقیمی باهم دارند این رابطه به صورت زیر است:
V = constant * T
-
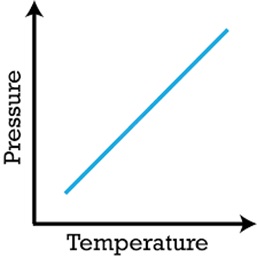
قانون گاز آمانتون [۴]
رابطه بین دما وفشار گاز، برای یک گاز با جرم وحجم ثابت را قانون آمانتون می گویند. این قانون توسط آمانتون فیزیک دان ومخترع فرانسوی در قرن ۱۷ میلادی کشف شد. طبق این رابطه برای گازی با جرم وحجم ثابت فشار گازرابطه ی مستقیمی با دمای گازدارد :
p = constant * T
-
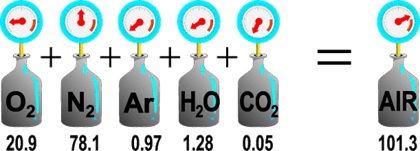
قانون گاز دالتون :[۵]
این قانون را اولین بار جان دالتون انگلیسی، در آزمایشاتش، در سال ۱۸۰۱ میلادی مشاهده کرد. این قانون می گوید که در یک محفظه ی پر از گازهای مخلوط، فشار کل گازهای محفظه برابر مجموع فشارهای جزئی تک تک گازهای تشکیل دهنده ی آن مخلوط می باشد :
Ptotal = P1 + P2 + P3 + .... + Pn
-
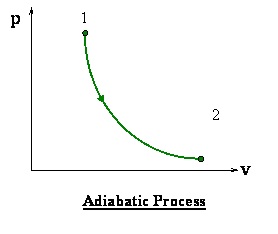
قانون گاز پوآسون ۴۵
این قانون که از آن در فرایندهای بی دررو[۶] استفاده می کنند، از ترکیب قانون اول ترمودینامیک و قانون گازایدهآل به دست آمده است . فرآیند بی دررو به فرآیندی گفته می شود که انتقال حرارت آن با محیط ناچیز باشد.Kدر واقع نسبت اتمسیته ی گاز است کهبه صورت نسبت گرمای ویژه گازدر فشارثابت به گرمای ویژه ی گاز در حجم ثابت تعریف می شود . (cp/cv)
p*vk=constant
-
قانون آووگادرو[۷]
این قانون در سال ۱۸۱۱ توسط آووگادرو، شیمیدان ایتالیایی بیان شد. این قانون می گوید که به ازای دو حجم مساوی از دو گاز مختلف، به شرطی که دما و فشار دو گاز باهم برابر باشند، فارغ از نوع گازها، تعداد یکسانی مولکول در درون هر دو گاز موجود می باشد . طبق آزمایشی که آووگادرو انجام داد، برای هر گاز با حجم ۲۲٫۴۱ لیتر، فارغ از نوع گاز، ۲۳ ۱۰× ۶٫۰۲۲ مولکول وجوددارد. این عدد به عدد آووگادرو مشهوراست.
-
قانون گاز ایده آل[۸]
مدل گاز ایده آل ، مدل نسبتا خوبی برای پیش بینی رفتارگاز در دماها وفشارهای معمولی ارائه می دهد که البته دارای محدودیت هایی می باشد. این مدل اولین بارتوسط کلاپیرون، در سال ۱۸۳۴ با ترکیب دو قانون شارل و بویل به دست آمد.این معادله با این فرض به دست می اید که حجم مولکول های تشکیل دهنده ی گازها ناچیز است و مولکول ها با هم به صورت الاستیک برخورد می کنند، یعنی مولکول ها باهم هیچ تعاملی ندارند. این معادله را نباید در فشارهای بالا و دماهای پایین استفاده کرد(به نمودارهای تراکم پذیری، فشارها ودماهای بحرانی در کتب ترمودینامیک کلاسیک مراجعه شود). البته برای به کاربردن این معادله در فشارهای بالا از ضریبی به نام ضریب تراکم پذیری Z استفاده می شود که در خلا، به علت فشارهای پایین کاربرد ندارد. صورت کلی این قانون به صورت زیر می باشد که در آن p فشار، v حجم گاز، n تعداد مول های گاز، T دمای گاز و R ثابت گاز می باشد که مقدار آن برای گازهای مختلف فرق می کند:
PV = nRT
-
معادله ی واندروالس [۹]
این معادله در واقع همان معادله ی گازکامل است بااین تفاوت که، برای ذرات موجوددر گاز،حجم در نظر گرفته می شود وهمچنین برخلاف مدل اتمی گازکامل که ازاثرمولکول هابر هم صرف نظر می شود، در این معادله، این اثرها نیز لحاظ می شود ودرکل نسبت به مدل گازکامل مدل بهتری می باشد . این معادله را واندروالس در سال ۱۸۷۳ بیان کرد. شکل کلی معادله به صورت زیر می باشد که در آن ضرائب a' و b' برای هرگاز متفاوت است:
-
معادله ی کلاپیرون - کلازیوس [۱۰]
این معادله در واقع نشان دهنده ی رابطه ی بین تغییرفاز ناپیوسته ی بین دو فازاز یک ماده ی مشخص می باشد.این معادله به صورت زیر می باشد که درآن L آنتالپی تبخیر، T دمای تبخیر وvm,vوvm,lنشان دهنده ی حجم مولی بخار یا مایع می باشند:
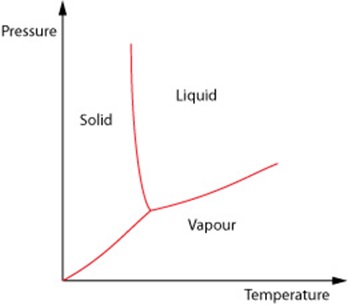
در شکل زیر نمودار تغییرات فشار- دمای ماده ای مانند آب را به ازای تغییرات فاز، در هر سه فاز ماده را نشان می دهد:
برگرفته ازسایت"http://www.doitpoms.ac.uk"
-
تئوری انرژی جنبشی گازها :
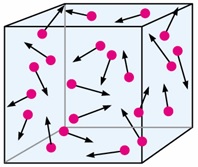
تئوری انرژی جنبشی گازها، گازهارا به صورت مجموعه ای از ذرات اتم یامولکول می نگرد که دردرون هم دارای حرکات تصادفی هستند وباهم وبادیواره های نگه دارنده ی گازبرخورد می کنند. این تئوری توانایی تعیین خواص ماکروسکوپیک گاز همچون فشار، دما، رسانندگی گرمایی و غیره راداراست. این تئوری ثابت می کندکه فشاریک گاز،ناشی از برخورد اتم های گاز به دیواره ها ی نگه دارنده ی آن گاز می باشد . این تئوری دمارا به شیوه ای متفاوت با ترمودینامیک کلاسیک توصیف می کند .
در این تئوری فرض هایی در نظرگرفته می شود که در زیر به آنها اشاره می کنیم:
- گازهااز ذرات بسیارریزی به نام مولکول ساخته شده است. حجم این ذرات در مقایسه با حجمی که گازدر آن قرارگرفته است بسیارناچیز می باشد. این بدان معناست که فاصله ی بین مولکول های گازدر مقایسه به اندازه ی خود ذرات بسیاربزرگتراست.
- تمام این ذرات جرم یکسانی دارند.
- تعدادذرات بقدری زیاداست که باید از روش های آماری برای تخمین رفتارآنها استفاده کرد.
- این ذرات دارای رفتارکاملا تصادفی می باشند .
- این ذرات غالبا دارای حرکت های سریع وتصادفی هستند. این حرکات سریع،سبب برخورد بین خودذرات و ذرات بادیواره ها می شود. این برخوردها الاستیک فرض می شوند یعنی ذرات پس ازبرخورد، به صورت کروی کامل باقی می مانند.
- به استثنای برخورد مولکول ها، تبادل انرژی بین مولکول ها وجود ندارد.
- انرژی جنبشی متوسط ذرات طبق این تئوری، تنها به دمای مطلق سیستم بستگی دارد.
- زمان برخورد مولکول ها به دیواره در مقایسه بازمان دو برخورد متوالی مولکول ها ناچیزاست .
- چون مولکول هادارای جرم هستند بنابراین تحت تاثیرجاذبه قرار می گیرند.
مراجع:
[۱]. http://www.grandinetti.org
[۲]. http://resources.yesican-science.ca
[۳]. http://www.arca53.dsl.pipex.com
[۴]. http://www.doitpoms.ac.uk
[۵]. http://chemistry-batz.wikispaces.com
[۶]. http://quantumfreak.com
پا نوشت: